Prórroga del marcado UKCA y modificación del Reglamento (UE) 2023/607
Fecha: 08 de junio de 2023
El 27 de abril de 2023, la MHRA anunció oficialmente la aceptación del Reglamento Modificatorio (UE) 2023/607 para los certificados MDD y AIMDD como válidos para la comercialización de productos con marcado CE en el mercado de Gran Bretaña de la siguiente manera:
- Productos implantables no WET de las clases III y IIb hasta el 31 de diciembre de 2027
- Productos de clase IIb WET, clase IIa, clase Im e Is hasta el 30 de junio de 2028
Por favor, tenga en cuenta que estos productos solo se aceptan si se cumplen en su totalidad los requisitos establecidos en el Reglamento (UE) 2023/607. Para beneficiarse de estos plazos ampliados, los fabricantes también deben registrarse en la MHRA.
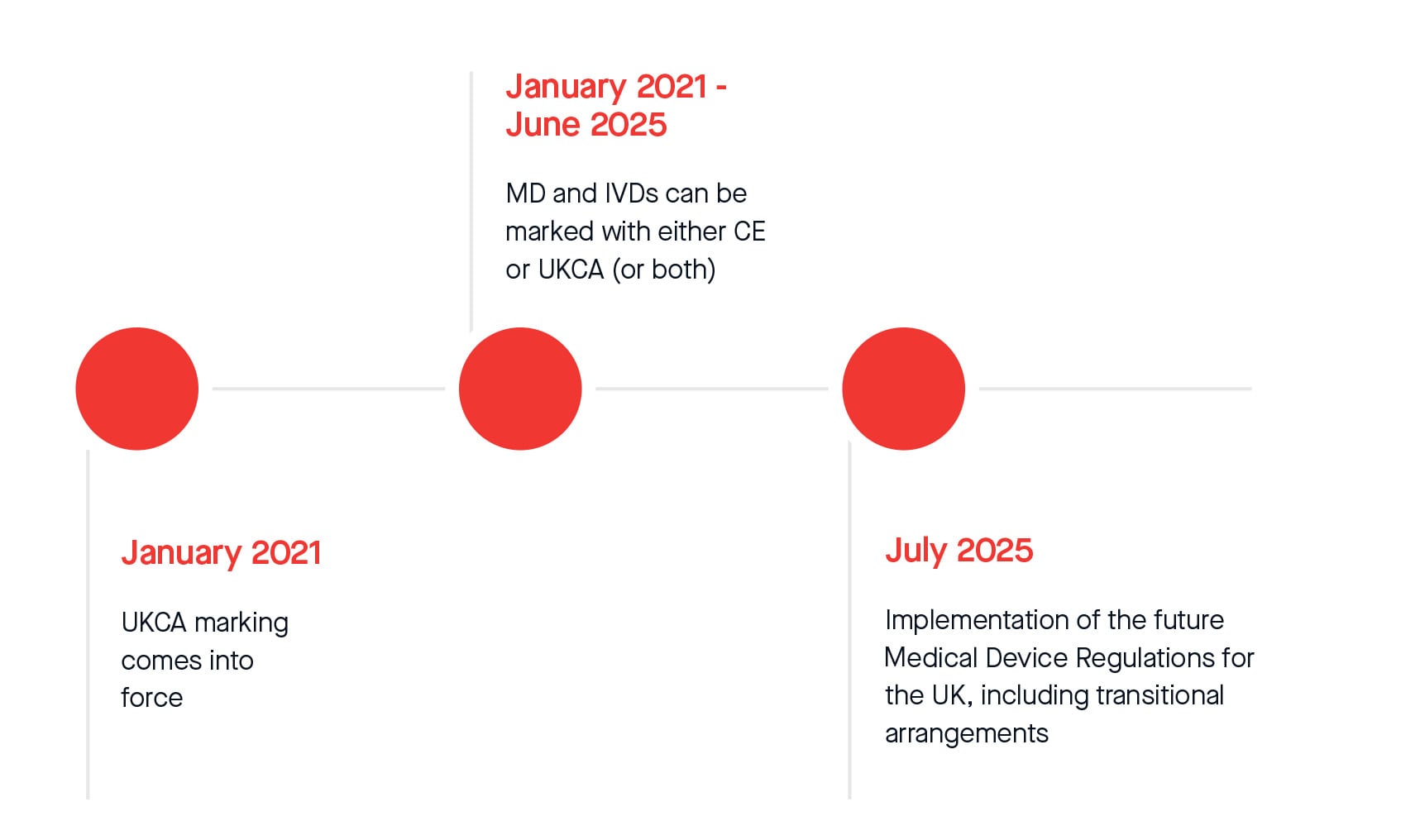
Además, la MHRA anunció oficialmente una prórroga adicional de doce meses al actual periodo de espera para el cumplimiento de la normativa de marcado UKCA. A partir del 1 de julio de 2025, se aplicarán disposiciones legislativas transitorias para la comercialización de todos los productos sanitarios y productos sanitarios para diagnóstico in vitro en el mercado británico. A continuación se presentan los plazos actuales que podrían estar sujetos a cambios después de que el Instrumento Estatutario (S.I. por sus siglas en inglés) sobre las disposiciones transitorias obtenga la aprobación parlamentaria y entre en vigor. Lo mismo se aplica a los plazos ampliados de conformidad con el Reglamento Modificatorio (UE) 2023/607.
Consulte a continuación el calendario transitorio revisado:
Aunque las ampliaciones de plazo aportan cierta tranquilidad, le instamos encarecidamente a que presente su propuesta firmada y la documentación técnica totalmente conforme lo antes posible, para minimizar el riesgo de no completar la evaluación de conformidad a tiempo. BSI programará y llevará a cabo las revisiones lo antes posible en función de la disponibilidad de los revisores.
BSI continuará aceptando solicitudes UKCA bajo las legislaciones actuales caso por caso, por favor contacte con su gestor de programa para más detalles.
Nuestra prioridad sigue siendo mantener la seguridad de los pacientes y garantizar revisiones conformes de todos los productos dentro de los marcos normativos actuales y futuros.
Encontrará más información en la página web GOV.UK y en nuestra página web dedicada al marcado UKCA.
Reciba un cordial saludo,
Vishal Thakker
Head of UK Approved Body
Regulatory Services (Medical Devices), BSI



